الفرق بين الرابطة الايونية والتساهمية

هذه الأيونات بشحنات متضادة سواء السلبية والإيجابية.
الفرق بين الرابطة الايونية والتساهمية. الفرق الرئيسي المركبات الأيونية مقابل التساهمية. هذا ال الفرق الرئيسي بين المركبات الأيونية و التساهمية. مقارنة بين الرابطة الايونية والتساهمية والفلزية كتابة lamia آخر تحديث. 08 يوليو 2019 23 23 محتويات.
فإذا أردنا أن نقارن بين الرابطتين الأي ونية والتساهمية فيجب أن نقارن بين رابطة واحدة من كل منهما وهذا مثال لما نقول. الرابطة الأيونية أو الرابطة الشاردية هي الرابطة التي تنشأ بين ذرتين تختلفان في المقدرة على كسب أو فقد الإلكترونات وتكون بين أيوني هاتين الذرتين الموجب والآخر السالب الشحنة فتنشأ قوة جذب كهربائي بينهما وتختلف نسبة. والتعريف الأساسي للمركب أيوني غير أنهم الجزيئات التي تتكون من أيونات مشحونة. وقد قام باقتراح ما يسمى ببناء لويس أو الشكل الإلكتروني النقطي والذي يكون.
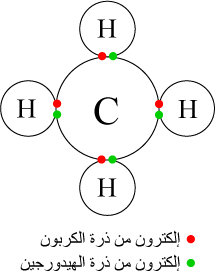
فكرة الترابط التساهمي يمكن أن ترجع إلى جيلبرت إن لويس والذي قام في عام 1916 بوصف مساهمة أزواج الإلكترونات بين الذرات. الفرق بين المركبات الأيونية والتساهمية يمكن أن يكون مربكا. الفرق بين الرابطة الأيونية و التساهمية. بشكل عام تميل العناصر المعدنية إلى تكوين مركبات أيونية والعناصر غير المعدنية تنتهي لتشكيل روابط تساهمية.